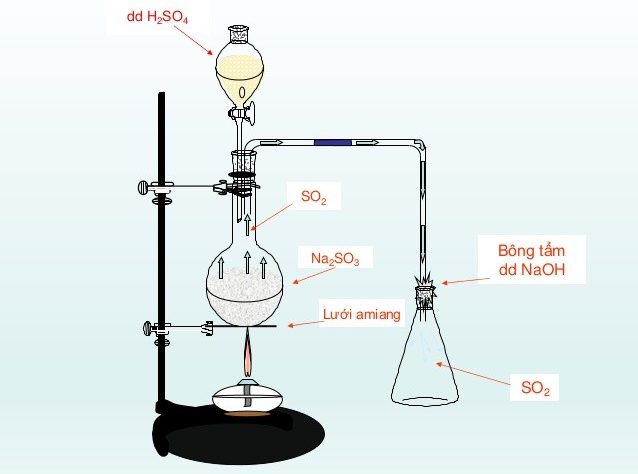
NaOH + H2SO4 là một phản ứng trung hòa giữa một bazơ mạnh và một axit mạnh do vậy phản ứng trên thường là phản ứng 1 chiều thuận. Khi NaOH tác dụng với H2SO4 điều chế được chất gì? sau phản ứng, Sau khi kết thúc phản ứng chúng ta thu được một dung dịch đồng nhất không màu, không mùi . . . đó là Na2SO4. Mời các bạn cùng chúng tôi theo dõi thí nghiệm.
Phương trình phản ứng H2SO4 ra Na2SO4 :
2NaOH + H2SO4 → Na2SO4 + 2H2O
Phản ứng giữa NaOH + H2SO4 xảy ra ở nhiều điều kiện như h2so4 loãng, h2so4 đặc nóng, h2so4 đặc nguội nhưng đều tạo thành muối trung hòa là na2so4 và nước.
– Điều kiện: Phản ứng trên xảy ra ở điều kiện bình thường. Học sinh có thể viết phản ứng mà không cần phải lưu ý đến điều kiện.
– Xúc tác: Phản ứng trên xảy ra cũng không cần chất xúc tác nào can thiệp bởi NaOH là một bazơ mạnh và H2SO4 cũng là một axit mạnh. Chúng có thể phản ứng với nhau mà không cần bất kì chất nào cổ vũ hoặc mô kích.
– Loại phương trình: Phản ứng trên thuộc loại phản ứng trung hòa tức là sau khi phản ứng kết thúc [ở điều kiện đủ] thì chúng ta sẽ thu được một dung dịch không còn tính axit hay bazơ nữa.
Nội dung xem thêm :
Bạn có biết: Dung dịch NaOH tác dụng với axit, tạo thành muối và nước.
Các phương trình điều chế ra Na2SO4
NaOH + NaHSO4 ⟶ H2O + Na2SO4
NaCl + NaHSO4 ⟶ HCl + Na2SO4
SO3 + Na2SeO4 ⟶ Na2SO4 + SeO3
Br2 + H2O + Na2SO3 ⟶ Na2SO4 + 2HBr
TÍNH CHẤT LÝ HÓA CỦA NA2SO4
Tính chất vật lý của NA2SO4 là gì?
NA2SO4 có màu trắng, không mùi và có vị đắng.
NA2SO4 có khối lượng mol là:
Khan: 42.04 g/mol
Đecahiđrat: 322.20 g/mol
NA2SO4 có khối lượng riêng:
Khan: 2.664 g/cm3
Đecahiđrat:1.464 g/cm3
Điểm nóng chảy:
Khan: 884 °C
Đecahiđrat: 32.38 °C
Điểm sôi đối với dạng khan: 1429 °C
Độ hòa tan trong nước
Khan: 4.76 g/100 mL (0 °C)
Đecahiđrat: 42.7 g/100 mL (100 °C).
Tính chất hóa học của NA2SO4 là gì?
NA2SO4 có tính bền vững:
NA2SO4 không bị oxy hóa khử ở nhiệt độ bình thường nhưng ở điều kiện có xúc tác là nhiệt độ cao thì nó có thể tác dụng với cacbon (bị khử)
Na2SO4 + 2 C → Na2S + 2 CO2.
NA2SO4 có tính bazơ:
Natri sunfat có thể phản ứng với axit sunfuric tạo muối axit natri bisunfat:
Na2SO4 + H2SO4 ⇌ 2 NaHSO4
Lưu ý: Với nồng độ và nhiệt độ khác nhau chúng ta sẽ có hệ số căn bằng khác nhau.
NA2SO4 có tính chất trao đổi ion
Natri sunfat là muối ion điển hình, chứa các ion Na+ và SO42−. Sự có mặt của sunfat trong dung dịch được nhận biết dễ dàng bằng cách tạo ra các sunfat không tan khi xử lý các dung dịch này với muối Ba2+ hay Pb2+:
Na2SO4 + BaCl2 → 2 NaCl + BaSO4 (Kết tủa)